


医薬品等適正広告基準は、薬機法の補完として医薬品や化粧品の広告表現を規定するガイドラインです。
2017年改正で表現の幅が見直され、ビフォーアフターの使用や「低刺激」表示が条件付きで可能になりました。また、誇大広告や推薦表現、臨床データの使用は禁止され、違反には罰則もあります。広告の内容は媒体や対象によっても規制が異なるため、慎重な対応が求められます。
NTTDoCoMoやハウス食品やエーザイなど上場企業と継続的に取引をし、わかさ生活に薬機法広告の専門家としてインタビューを受けるなどの実績をもつLifelighterでは、「AIにを脅威に感じている」という人向けに、毎月先着3名様限定で無料の個別相談を行っています。
薬機法(薬事法)って何?
薬機法(薬事法)とは、医薬品や化粧品、医薬部外品などの販売や製造、表現方法などに関するルールを定めた法律です。正式名称を「医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律」といいます。
2014(平成 26)年 11 月25日の薬事法改正により、内容も一部改正され法律名も「医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律」へと名称変更となりました。
薬機法(薬事法)と医薬品等適正広告基準の関係
医薬品等適正広告基準とは
医薬品等適正広告基準とは、医薬品や医薬部外品、化粧品などの広告表現に関する基準を定めたガイドラインです。
薬機法が扱う範囲は膨大です。どうしても法律という大きな枠組みだけでは、細かな部分まで規制しきれません。
そこで、
薬機法の条文とは別に、医薬品や化粧品などの広告表現の基準や注意点などについてまとめたものが、「医薬品等適正広告基準」
です。
薬機法における広告表現の指針としては、医薬品等適正広告基準のほかに、「化粧品ガイドライン」というものがあります。
医薬品等適正広告基準は厚生労働省が出していますが、化粧品ガイドラインは日本化粧品工業連合会(粧工連)が出しています。


2017年9月の改正で規制内容が大きく変わった
2017年9月の医薬品等適正広告基準改定では、表現できる範囲が大きく変わりました。
誇大広告に関連する項目は総じて厳格化しています。
誇大広告に関連する項目は総じて厳格化された
例
- 医師等の推薦表現に「学会」「薬局」も加わる
- 「こえないものとする」→「こえてはならない」に文言変更される
一方規制の必要性に乏しい項目は緩和されているものもあります。
規制の必要性に乏しい項目は緩和された
例
- ビフォーアフターの掲示が可能になる
- アルファベット名称の併記が可能になる
医薬品等適正広告基準|改正点を含む10つのポイントを解説
1:アルファベット名称の併記も可能に
改正前は、医薬品等のふり仮名を振る場合、ひらがな、もしくはカタカナのみが認められていました。
しかしグローバル化が進んだ現在では、外国人が医薬品等を使用するシーンも想定しなければなりません。
そこで改正後はアルファベットの併記も可能となりました。
医薬品等の同一性を誤認させるおそれがない範囲で、「漢字」に「ふりがな」をふること及びアルファベットを併記することは差し支えない。
医薬品等適正広告基準第1(3)
2:しばりの表現の省略がテレビ、ラジオ広告における漢方剤のみ可能に
改正前は、いかなる場合もしばり表現の省略は不可とされていました。
本改正で漢方剤に限りテレビ、ラジオにおける効能効果等のしばり表現が省略できるようになりました。



ただし「この○○○は、体質、症状に合わせてお飲みください。」等の注意喚起の文言を付け加える必要があります。
②効能効果等のしばり表現の省略について
テレビ、ラジオにおける効能効果等のしばり表現は、当面、漢方製剤に限り省略できるものとするが、その場合は必ず「この○○○は、体質、症状に合わせてお飲みください。」等の注意喚起の旨を付記又は付言しなければならない。医薬品等適正広告基準第3(4)
効能効果のしばり表現の省略が認められるのは、「テレビ、ラジオ」における「漢方薬剤」のみです。テレビ、ラジオにおける漢方薬剤以外のしばり表現は現段階では省略は認められません。
しばり表現の省略が認められない例
- 化粧品のしばり表現(乾燥による小ジワを防ぐ、日焼けによるシミ・そばかすを防ぐなど)
- インターネット広告おける漢方薬剤のしばり表現
- チラシにおける漢方薬剤のしばり表現
3:製造法の褒め上げの禁止
医薬品等の製造方法について最大級の表現、またはそれに類する表現をすることは優秀性について誤認を与えるため、禁止されています。
(1)製造方法等の優秀性について
医薬品等適正広告基準4(2)1
最大級の表現に類する表現は、その優秀性について事実に反して誇大に誤認させるおそれがあるため認められない。
【NG】
- 「最高の技術」
- 「最も進歩した製造方法」
- 「近代科学の粋を集めた製造方法」
- 「理想的な製造方法」



なお「特許」についても認められません。
本改正で加わった規制ではありませんが、違反が多いですので気をつけましょう。
4:併用表現の除外規定の明確化
改正前から、承認等により併用を認められた場合を除いて「併用に関する表現は原則認めない」とする規定がありました。
今回の改正で「原則」ではなく併用表現の除外規定が明確化しました。
(1)併用に関する表現について
医薬品等適正広告基準(4)1
併用に関する表現は認められない。ただし、承認等により併用を認められた医薬品等及び化粧品(「化粧品基準及び医薬部外品の製造販売承認申請に関する質疑応答集(Q&A)について」(平成 28 年3月30 日付厚生労働省医薬・生活衛生局審査管理課事務連絡)で定める範囲)を除く。
ただし、承認等により併用を認められている場合や、混ぜて使うことを前提とした化粧品は例外的に併用表現が認められています。
【併用表現の除外規定】
- 承認等により併用を認められているもの
- 「使用時に混合して用いる用法」の化粧品であり、製造販売業者の責任のもとに安全性が担保されているもの
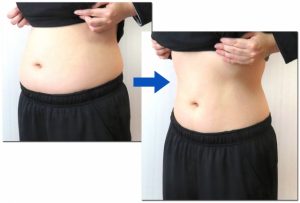
5:ビフォーアフターの掲示が可能に
改正前は、ビフォーアフターの掲示一切認められていませんでしたが、本改正で一定の条件を満たした場合、ビフォーアフターの掲示も可能になりました。
ビフォーアフターの掲示が認められる条件とは以下の3つです。
ビフォーアフターの掲示が認められる3要件
- 効能効果を逸脱していない
- 発現時間、効果持続時間の保証表現にあたらない
- 安全性の保証表現にあたらない
ビフォーアフターがOKになった背景とは?
これまで使用前・使用後の写真は医薬品等の効能効果、あるいは安全性の保証表現となるため一切不可とされていました。しかし法の穴をかいくぐるように「使用中」や「使用方法」の図を使って効果効能を保証(強調する)ケースがでてきました。
ところが、行政としては「使用前・使用後」という基準にとらわれるあまり、「使用中」や「使用方法」の表示が保証につながっているケースについて、指導ができなかったのです。
実質上は違反となるケースも取り締まれない状況を解消するために、改正後は一定の条件を満たせば使用前・使用後の写真やイラストの使用を認めることになったわけです。

6:使用体験談について
個人の感想は客観的裏付けとはなりえず、かえって消費者に対し効能効果等又は安全性について誤解を与えるおそれがあります。感謝状や「私も使っています」などの使用経験談的広告は、認められません。
【感謝状や体験談的広告はNG】
- 愛用者の感謝状
- 感謝の言葉等の例示
- 「私も使っています」
例外的に
目薬や外皮用剤(軟膏クリーム、保湿ジェルなど)の、化粧品等の広告で使用感を説明する場合や、タレントが単に製品の説明や呈示を行う場合は口コミ体験談の標ぼうも可能です。
口コミ体験談の標ぼうが可能なケース
①目薬や外皮用剤(軟膏クリーム、保湿ジェルなど)で、化粧品等の広告で使用感を説明する場合
②タレントが単に製品の説明や呈示を行う場合
ただ、口コミ体験談は違法性の判断が難しいのが実際です。
口コミが違反となるケースや違法性の考え方は以下の記事が参考になります。






7:「○○専門」など特定の年齢性別が表示可能に
改正前は、医薬品等の年齢・性別に制限がある医薬品等を除き、「特定の年齢性別の使用表現を不可」とされていました。
しかし性別や年齢層にかかわらず使えるものを「特定の年齢性別の人に使える=○○専門」としたところで、消費者に不利益を与えるものではありません。
そこ改正後は
「〇〇専門」の表現は他社誹謗や優位性の強調にならない限り可能
になりました。
「○○専門薬」等の表現について
特定の年齢層、性別などを対象にしたもの、例えば「小児専門薬」、「婦人専門薬」などの表現は、本基準第4の3(1)「承認等を要する医薬品等についての効能効果等の表現の範囲」に抵触するおそれがあり、かつ、医薬品広告の表現としては好ましくないため、承認を受けた名称である場合以外は使用しないこと。医薬品等適正広告基準第4(4)2
ただし
「小児専門薬」「婦人専門薬」は認められません(承認名称の場合を除く)。
「○○専門」の表現について詳しくはこちらで解説しています。
-「便秘」は使える?-15-300x200.png)
-「便秘」は使える?-15-300x200.png)
8:一般向け広告における臨床データの例示の禁止
一般向けの広告で臨床データや実験例等を例示すると、消費者は効能効果等や安全性について誤解するおそれがあります。そのため一般向けの広告では臨床データや実験例の表示は認められません。
一般向けの広告にあっては、臨床データや実験例等を例示することは消費者に対して説明不足となり、かえって効能効果等又は安全性について誤解を与えるおそれがあるため原則として行わないこと。
医薬品等適正広告基準第4(5)3
たとえば
「製品を使った患者の血糖値を示す」ことや「他社製品との比較実験例を掲載する」ことは認められません。
NG
- 「製品を使った患者の血糖値を示す」
- 「他社製品との比較実験例を掲載する」



臨床データや実験例等を載せると
広告を見たお客さんが
「臨床データがのっているから効果があるんだろう」
「実験例が記載されているくらいだから安全なものなんだろう」などと考えるリスクがある、ということですね。
一方、
比較広告そのものは違法ではありません。ただし比較広告もやり方次第では薬機法や景品表示法に抵触するおそれがあります。
比較広告が適法となるためのポイントについてはこちらの記事で詳しく解説しています。




9:「新発売」「新しい」は12か月使用可能に
改正前は、「新発売」「新しい」等の表現は、製品発売後6か月が目安でした。
改正後は
「新発売」「新しい」等の表現を製品発売後 12 ヵ月間を目安に使用できるようになります。
10:炎症部分の炎症が消える場面の表現について
改正前は、テレビ広告、ウェブサイト等で用いる、図やイラスト、アニメーション等で医薬品等の使用により患部の炎症等が消えるかのような印象を与えることは認められませんでした。
しかし「炎症等が消える表現をしたところでただちに誤認を与えるわけではない」との判断から改正後は
効能効果の保証的表現とならないよう留意すれば炎症が消える表現も可能
になりました。
11:副作用のうち「眠くなりにくい」「低刺激」が表示可能に
改正前は、副作用に関する標ぼうは一切認められていませんでした。安全性を標ぼうすることで、過剰摂取を促したり、適切な治療機会を失わせたりして消費者の健康を損ねるリスクがあるからです。
ですが「低刺激」「眠くなりにくい」については表示したところでただちに過剰摂取を促したり、適切な治療機会を失わせたりするものではありません。
そこで本改正では
科学的根拠があり、かつ安全性の保証につながらない場合は、「低刺激」「眠くなりにくい」の表示が可能になりました。
「低刺激」「眠くなりにくい」の表示が可能になる条件
- 科学的根拠がある
- 安全性の保証につながらない
一方で、医薬品等適正広告基準第4(9)の他社の製品の誹謗広告に抵触しないように注意する必要があります。
(8)副作用等の表現について
「副作用が少ない」、「比較的安心して・・・」、「刺激が少ない」等の表現は安全性について誤認させるおそれがあるため、使用しないこと。
ただし、低刺激性等が立証されており安全性を強調しない場合及び「眠くなりにくい」と表現することは、その製剤として科学的根拠があり安全性の保証につながらない場合に限り認められるが本基準第4の9「他社の製品の誹謗広告の制限」に抵触しないように注意すること医薬品等適正広告基準第4(5)8
12:医薬品の多数購入・多額購入による値引き広告の禁止
医薬品に関して、多数購入又は多額購入することによる過度な値引き広告は、消費者に不必要な購入を促すことになるため禁止されています。(医薬品等適正広告基準第4(8)4)
13:誹謗広告の禁止


医薬品等の品質、効能効果、安全性その他について、他社の製品を誹謗するような広告は認められません。
他社の製品を誹謗する広告とは次のようなものです。
注意したいのが、他社製品の品質等をあげつらって悪評する、いわゆる誹謗中傷のみならず、客観的な事実を述べる場合でも他社を貶めるような内容は不可となる可能性がある点です。




14:「薬局」「学会」による推薦表現も不可に
医薬品等の推せん広告等は、一般消費者の認識に与える影響が大きいことから一定の場合を除き、事実であったとしても認められません。
改正前は、「医師」や「教授」「博士」などが推薦が禁止されていました。
改正では
医薬品等の推せん広告等の箇所に「薬局」「学会」が加わりました


医薬品等適正広告基準の罰則
- 2年以下の拘禁もしくは200万円以下の罰金(または併科)
誇大広告の禁止に該当した場合「2年以下の拘禁もしくは200万円以下の罰金(または併科)」が課せられます。
- 対象商品の売り上げ額×4.5%の課徴金
令和3年8月1日より課徴金制度が開始し、誇大広告をおこなった場合「対象商品の売り上げ額×4.5%」の課徴金を課せられるようになります。ただし減額規定も設けられており、自主申告した場合課徴金は減額されます。
よくある質問
質問:医薬品等の広告の3要件は?
医薬品等の広告の3要件とは「①明示性:商品名が明らかにされていること」「②誘因性:顧客を誘引する意図があること」「③一般性:一般人が簡単に閲覧できる状態にあること」です。
①の明示性は、商品名そのものは明示されていなくても、商品の認知度や写真、説明文等から特定の商品であることがわかる場合は明示性があるとみなされます。
②の「顧客を誘引する意図」にはたとえば金額を示すことなどが該当します。
③の「一般人」とは、広告を行っている者以外の者を指します。




質問:医薬品等適正広告基準に違反するとどうなるの?
医薬品等適正広告基準に違反した場合、刑事処分の対象になったり、媒体審査に落ちたりするリスクがあります。
医薬品等適正広告基準の1~3は、薬機法法第66条第1項(誇大広告の禁止)の解釈です。
違反した場合「2年以下の拘禁または200万円以下の罰金もしくはその両方」が課せられるおそれがあります。
医薬品等適正広告基準の4~14は広告の適正化をはかるため遵守すべき事項を示したものであり、違反しても行政処分や刑事処分の対象にはなりません。
ただし、媒体審査に落ちるリスクはあります。
質問:医療用医薬品等の一般人向け広告の禁止とは?
医薬品のなかでも、医師の診断や処方箋が必要となる「医療用医薬品」は一般向け(医療関係者以外)の広告が禁止されています。
質問:医薬品等の広告で注意すべきことは何?
広告が消費者に与える印象は、文章表現やイラスト、写真といった広告そのものの内容だけでなく、前後の文脈や位置関係、利用される媒体の性質などによって異なります。
誇大広告に該当するかどうかは「医薬品等適正広告基準」や「医薬品等適正広告基準の解説及び留意事項」の内容をカバーしてさえいればいいというわけではなく、様々な要素を総合的に勘案して判断することが必要です。
たとえば臨床データの表示が禁じられているのは「一般消費者向け」の広告であり、メーカー用品のパンフレットや医療機関向けの広告などは適用対象となりません。
また多数購入・多額購入による値引き広告の禁止は医薬品や指定医薬部外品、再生医療等製品医薬品が対象です。医薬部外品、薬用化粧品や化粧品にも過量消費や乱用助長を促する広告は禁止されているものの、値引きについての規定はありません。
広告のターゲットが「一般消費者」なのか「業者」なのか「医薬関係者」なのか、広告の対象が
「医薬品」「医療機器」「化粧品」のいずれなのかといった点まで考慮して広告作成にあたることが肝要といえるでしょう。
医薬品等適正広告基準は美容健康広告の羅針盤!しっかり頭に入れてホワイトな訴求を
医薬品等適正広告基準は、美容健康広告の肝となる指針です。美容健康ジャンルにかかわるライターやマーケッターはしっかり把握しておきましょう。
Life-lighterでは、日本でただ一人消費者庁の公的文書の誤りを指摘・是正に貢献した実績をもち、消費者庁と公正取引協議会の資格「景品表示法務検定」のアドバンスクラスを取得済(合格者番号APR22000 32)、わかさ生活に薬機法の専門家としてインタビューをうけた実績などをもつ専業薬機法ライターが広告法務をサポートしています。
- 薬機法ライティング
- 広告制作
- 薬機法チェック(非弁行為に当たらない方法)
- セミナー
- 社内研修
などのサービスを提供しているほか、視聴期限なしで永久伴走サポート付き、薬機法チェックやリライトのノウハウもお伝えしている「A×薬機法ライター養成講座」も運営しています。(現在モニター価格で募集中)まずはお気軽にご相談ください。














コメント