2019年11月27日に、薬機法が改正されました。
「誇大広告の厳罰化」や「責任役員の法的位置づけの義務化」など、ヘルスケア業界、特に広告に携わる方なら必ず押さえておくべきポイントがいくつか盛り込まれています。
改正の内容と実務への影響を実務に関わる部分に絞って解説いたします。
NTTDoCoMoやハウス食品やエーザイなど上場企業と継続的に取引をし、わかさ生活に薬機法広告の専門家としてインタビューを受けるなどの実績をもつLifelighterでは、「AIに負けないライターになりたいけれど方法がわからない」という人向けに、毎月先着3名様限定で無料の個別相談を行っています。
はじめにおことわりしておきますが、長いです。(1.5万文字あります)
ただその分網羅性は高いですので
- 「薬機法の最新の規制について詳しく知りたい」
- 「専門性を極めたい」
という方にはもってこいの内容となっています(「ctrl」+「F」で検索窓→「💡」で検索すれば要点だけ閲覧できます)
※スマホの場合
safari→上部の検索窓(URL窓)をタップ→「💡」を入力→下にでてくる「💡を検索」をタップ
Google Chrome→右下「・・・」をタップ→「ページ内を検索…」→「💡」で検索)
「細かな改正の内容より、現時点(2023年)での違反行為と罰則をサクッと知りたい!」という方はこちらの記事がおススメです。↓




景品表示法の知識を深めたい方はこちらの記事をどうぞ。




2019年薬機法改正の背景


薬機法は、2014年の薬事法改正で名称変更となった法律です。医薬品、医療機器等の品質、有効性及び安全性を確保することを目的としています。
施行後5年を目途に、改正後の実施状況を勘案し必要に応じて見直すことが定められていたため、今回の改正に至っています。
改正の目的は大きく次の2点です。
- 優れた医薬品、医療機器等をより安全・迅速・効率的に提供すること
- 患者が住み慣れた地域で安心して医薬品を使えるような環境を整備すること
国民のニーズに応える優れた医薬品、医療機器等をより安全・迅速・効率的に提供するとともに、住み慣れた地域で患者が安心して医薬品を使うことができる環境を整備するため、制度の見直しを行う
医薬品医療機器等法等の改正について 厚生労働省
💡今回の薬機法改正のテーマは大きく次の3点です。
- 高い品質・安全性を確保し、医療上の必要性の高い医薬品・医療機器などを迅速に患者に届ける制度改善
- 薬剤師・薬局のあり方の見直し
- 信頼確保のための法令遵守体制などの整備
以下、それぞれ解説していきます。
Ⅰ高い品質・安全性を確保し、医療上の必要性の高い医薬品・医療機器などを迅速に患者に届ける制度改善


背景
医療上の必要性が高いにもかかわらず、患者がほとんどないために研究開発が進んでいない病の医薬品や医療機器が存在することは1990年代前半から問題となっていました。
例)
- エイズ
- 脊髄小脳変性症
- 筋ジストロフィーなどを対象とする医薬品、医療機器
また国民の医療をめぐるニーズの多様化などに対応し、安全かつ良質な医薬品等を 1 日も早く医療の現場に提供することが求められていました。
このような国民の期待の高まりや、医薬品・医療機器の研究 開発をとりまく状況の変化等を踏まえ、1993年に薬事法を改正し「希少疾病用医薬品、希少疾病用医療機器25の指定制度」を導入することととなりました。
ところが日本は研究能力が高い反面、諸外国と比較し、実用化する能力が低いという問題もあったのです。最先端の治療薬を生み出すことができても、世界に先駆けて実用化しないと、特許などの知的財産権を取得できません。


そこで2015年と2017年に導入されたのが以下の制度です。
- 先駆け審査指定制度
- 件付き早期承認制度
治験段階で著しい有効性が見込まれる医薬品、医療機器等を指定し、優先的な取り扱いをおこなうことにより、承認取得までの期間を短縮し、日本でも早期に開発・申請ができるようになりました。
しかしいずれも厚生労働省の出す「通知」に基づく制度であったため機能しないケースがしばしばあり、法律に基づく制度とすることが求められていました。
そもそも医療機器の導入・改良には承認が必要ですが、継続的な改良が求められる医療機器も存在します。つまり承認を必要とする制度では対応できないのです。


そこで、今回の改正ではこれらの課題をクリアーするための制度の導入を「Ⅰ高い品質・安全性を確保し、医療上の必要性の高い医薬品・医療機器などを迅速に患者に届ける制度」という形で示しました。
💡Ⅰ高い品質・安全性を確保し、医療上の必要性の高い医薬品・医療機器などを迅速に患者に届ける制度の概用
a先駆け審査指定制度、条件付き早期承認制度の法制化
b医療機器の特性を踏まえた承認制度の導入
c添付文書の電子的方法による提供の原則化
a先駆け審査指定制度、条件付き早期承認制度の法制化


a先駆け審査指定制度、条件付き早期承認制度の法制化
先駆け審査指定制度、条件付き早期承認制度とは、世界に先駆けて開発され、早期の治験段階で著明な有効性が見込まれる医薬品などを指定し、優先審査などの対象としたり、一定の条件を満たせば、多くの被験者を対象とした検証的臨床試験をせずに承認を可能とする仕組みです。


先駆け審査指定制度、条件付き早期承認制度は次のように規定されています。
厚生労働大臣は、第一項の承認の申請に係る医薬品が、希少疾病用医薬品、先駆的医薬品又は特定用途医薬品その他の医療上特にその必要性が高いと認められるものであるときは、当該医薬品についての第二項第三号の規定による審査又は前項の規定による調査を、他の医薬品の審査又は調査に優先して行うことができる。
薬機法 第14第8号
国は、希少疾病用医薬品、希少疾病用医療機器及び希少疾病用再生医療等製品並びにその用途に係る対象者の数が本邦において厚生労働省令で定める人数に達しない特定用途医薬品、特定用途医療機器及び特定用途再生医療等製品の試験研究を促進するのに必要な資金の確保に努めるものとする。
薬機法 第77第3号
国は、租税特別措置法(昭和三十二年法律第二十六号)で定めるところにより、希少疾病用医薬品、希少疾病用医療機器及び希少疾病用再生医療等製品並びにその用途に係る対象者の数が本邦において厚生労働省令で定める人数に達しない特定用途医薬品、特定用途医療機器及び特定用途再生医療等製品の試験研究を促進するため必要な措置を講ずるものとする。
薬機法 第77第4号
先駆け審査指定制度や条件付き早期承認制度そのものは2015年から導入されていたのですが、法律ではなく通知※で運用されていたため、実効性に乏しかったのです。
改正法施行後は、「先駆的医薬品など」と「特定用途医薬品など」として法定されることになります。(改正薬機法2条16項)
(※)平成27年4月1日薬食審査発0401第6号「先駆け審査指定制度の試行的実施について
先駆け審査指定制度を簡単に説明すると…


💡①画期的な医薬品を優先的に審査する
厚生労働大臣は以下の2つを満たした医薬品について、薬事・食品衛生審議会の意見を聴いて先駆的医薬品、先駆的医療機器又は先駆的再生医療等製品に指定します。
- 日本・外国で承認を与えられている製品と作用メカニズム等が明らかに異なる
- その用途に関し、特に優れた使用価値を持つ
→「これまでにない優れた医薬品は先駆的医薬品などに指定し、優先審査などの対象としますよ」ということです。
💡②一定の条件を満たす医薬品を国が支援する
厚生労働大臣は以下の3つを満たす医薬品について、薬事・食品衛生審議会の意見を聴いて、特定用途医薬品、特定用途医療機器又は特定用途再生医療等製品に指定します。
- その用途が特定の区分に属する疾病の治療等である
- 当該用途に係る医薬品等に対するニーズが著しく充足されていない
- その用途に関し特に優れた使用価値を持つ
→「なかでも特定の条件を満たしたものは特定用途医薬品などとして、国が助成金などで支援しますよ」ということです。
条件付き早期承認制度を簡単に説明すると…
💡①条件付きで医薬品認証プロセスを簡略化
厚生労働大臣は以下の2つを満た医薬品について、臨床試験の試験成績に関する資料の一部の提出をしなくても認証することができます。
- 医療上特にその必要性が高いと認められる
- 検証的臨床試験の実施が困難である
→「臨床試験の実施が困難なケースでも承認をおこなうために、必要な場合、提出する臨床試験データの省略を認めますよ」ということです。
💡②製造販売承認への条件付与
厚生労働大臣は使用の成績に関する調査の実施、適正な使用の確保のために必要な措置の実施等の条件を付して、製造販売の承認をすることができます。
→「ただし、安全性の問題から、製造販売には条件をつけますよ」ということです。
💡先駆け審査指定制度および条件付き早期承認制度の法制化の施行期日は令和2年9月1日です。
[su_box title=”「先駆け審査指定制度、条件付き早期承認制度の法制化」によって何がどう変わった?” box_color=”#005488″]
✓世界に先駆けて開発され、治験段階の早期で高い有効性が見込まれる医薬品などを優先審査する「先駆け審査指定制度」が法制化された。
✓これにより国際的規制調和が前進した。
✓難病など患者数の少ない疾患に対する医薬品を条件付きでスピーディに承認する「条件付き早期承認制度」が法制化された。
✓これにより医療上の必要性があるにもかかわらず治験が難しいなどの理由で開発が進められなかった医薬品などの開発ができるようになった。
[/su_box]
b医療機器の特性を踏まえた承認制度の導入


Ⅰ高い品質・安全性を確保し、医療上の必要性の高い医薬品・医療機器などを迅速に患者に届ける制度改善
a先駆け審査指定制度、条件付き早期承認制度の法制化
b医療機器の特性を踏まえた承認制度の導入
c添付文書の電子的方法による提供の原則化
医療機器にもさまざまなものがあり、それぞれの特性を踏まえた規制が必要です。
- 医療用ガーゼ
- ピンセット
- 血圧計
- MRI
- ペースメーカー
- 冠動脈ステント

たとえば「一般医療機器」に分類されるものは、不具合が生じても人体へのリスクが比較的小さいため、導入に承認はいりません。
一般医療機器の例
- 医療用ガーゼ
- ピンセット
しかし「高度管理医療機器」に分類されるものは、不具合が生じた場合、人体へのリスクが大きいため導入には大臣の承認を必要とします。
高度管理医療機器の例
- ペースメーカー
- 冠動脈ステント
そして従来は医療機器の改良・改善には、厚生労働大臣の承認が求められました。
必要なデータがすべて集まってから改良改善の申請をし、審査を経て認可されればようやく改良、というながい工程を踏む必要があったわけです。


しかし医療機器のなかには、絶えず改良・改善が想定されるものもあります。
AIのように初回承認から性能等が常に向上し続けるプログラムが組み込まれているものもあります。
このような変化し続けることがあらかじめ明確な医療機器については変更に承認を必要とする制度では対応できないとの指摘がありました。
💡そこで改正法ではあらかじめ改良が見込まれている医療機器について、継続した改良を可能とする承認審査制度が導入されました。
改正内容


💡計画に従った変更をおこなう日の一定日数前までに届け出れば、承認を得ずに変更可能に
改正法施行後は
①医療機器などの承認を受けた者は、承認事項のうち性能、製造方法などの変更に関する計画について厚生労働大臣の確認を受けることができ
②確認を受けた者は、当該計画に従った変更をおこなう日の一定日数前までに届け出れば、承認を得ずに変更できるようになりました。(改正薬機法23条の2の10の2第6項)
💡継続した改良を可能とする承認審査制度の導入の施行期日は令和2年9月1日です。
参考:新医療機器等と改良・後発医療機器の区分および審査内容の違いについて|医薬品医療機器総合機構
c添付文書の電子的方法による提供の原則化
Ⅰ高い品質・安全性を確保し、医療上の必要性の高い医薬品・医療機器などを迅速に患者に届ける制度改善
a先駆け審査指定制度、条件付き早期承認制度の法制化
b医療機器の特性を踏まえた承認制度の導入
c添付文書の電子的方法による提供の原則化
医薬品や医療機器には「添付文書」と呼ばれる、使用上の注意や用法・用量、服用した際の効能、副作用などを記載した書面が添付されます※。これまで添付文書は紙だったのですが、紙の添付文書では迅速な情報伝達ができないという問題点がありました。
※ここでいう添付文書とは、医療機関や薬局に納入される医療用医薬品などに添付されるものを指します。一般用医薬品などの消費者が直接購入する医薬品のものは含みません(詳しくは後述)。
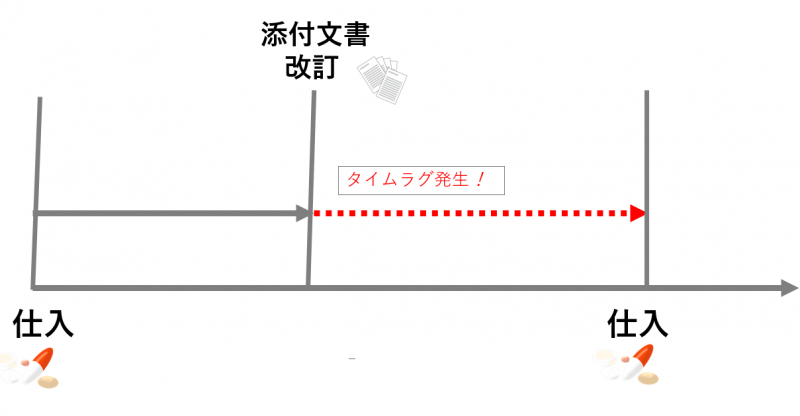

たとえばとある医療機関が2020年3月に、医薬品A を仕入れたとしましょう。そして2か月後の2020年5月に添付文書の内容が改訂されたとします。
すると、2020年5月以降に新しく医薬品A を仕入れるまで、医療機関にある在庫品は納入した時点(2020年3月)のもののままです。つまり添付文書の内容も改訂前のままになります。
仮に、重要な事項が改訂されていたとしても、手元にある添付文書には反映されていないため対応できません。
つまり紙の添付文書ではタイムラグが生じる問題があったのです。添付文書は頻繁に改定されるのでこうした事態は十分に起こり得ます。
また添付文書は資源浪費につながるとの声もあり、添付文書の電子的方法による提供が原則化が決定しました。
改正内容


💡添付文書情報の電子化が原則に
施行後は添付文書情報を電子化し、容器や外箱などの被包に、最新の注意事項など情報にアクセスするための番号や記号、その他符号を記載すること、注意事項など情報の提供をおこなうために必要な体制の整備をおこなうことが求められます。(改正薬機法52条1項、63条の2第1項、65条の3、68条の2、68条の2の2)
参考:医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律
※なお一般用医薬品などの消費者が直接購入する医薬品は、使用時に添付文書の情報の内容を直ちに確認できる状態を確保する必要があるため、紙媒体の同梱はこれまで通りおこなわれることになります。
💡添付文書の電子的方法による提供の原則化の施行期日は令和3年8月1日です。
[su_box title=”「添付文書の電子的方法による提供の原則化」により何がどう変わる?” box_color=”#005488″]
✓医薬品の添付文書の電子化が原則化されることが決定した。
✓これにより使用者への情報伝達のタイムラグを解消できる。
✓ペーパーレス化にも繋がることが期待される。
[/su_box]
Ⅱ薬剤師・薬局のあり方の見直し


背景
薬剤師・薬局の役割は、近年大きく変化してきており、ここ数年は薬剤師の取り組みが問われています。
それに対し行政としてさまざまな機会を通じて方向性を示してきました。
- 医薬分業
- 健康サポート薬局のスタート
- 調剤報酬改定など
とりわけ2015年10月23日、厚生労働省により「患者のための薬局ビジョン」~「門前」から「かかりつけ」、そして「地域」へ~ 」が発表されてからは、医業分業が推し進められてきました。
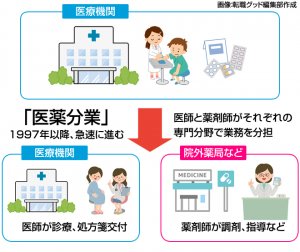

医薬分業とは薬の処方と調剤を分離し、それぞれを医師、薬剤師という専門家が分担しておこなうことです。医業分業ともいいます。
今は、受診や処方は病院でうけますが、薬をもらうのは薬局ですよね。簡単にいえば、これが医薬分業です。
昔は医師が処方をおこないそのまま院内で薬を処方する形がとられていました。この形態は患者にとってはかかりつけ医から直接もらえる安心感や一か所で済む利便性などはあります。
けれども薬材料で生計を立てていた医師が多かったため、過剰投薬などのいわゆる「薬漬け医療」の問題が生じるようになりました。
また「医薬分業」であっても、大規模病院の敷地内や周辺に出店した新興調剤薬局などによる医師へのリベート供与などの問題も起こりました。
そこで厚労省では平成5年(1993年)に「薬局業務運営ガイドライン」を発出し、薬局の在り方などに厳格なルールをもうけたのです。以後、医薬分業が急速に進むこととなります。
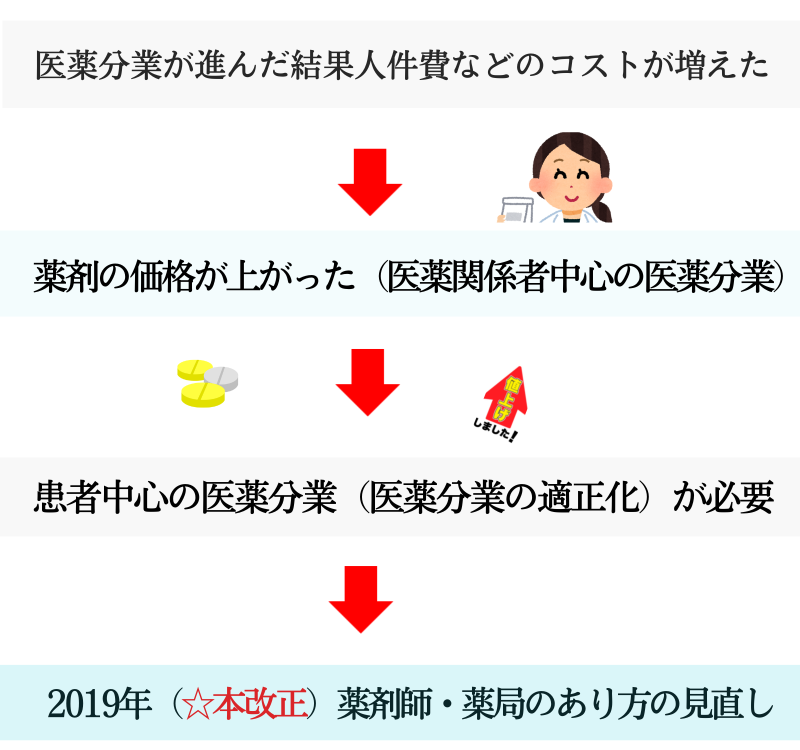
医業分業は進みましたが、一方で問題も出てきました。
薬の処方と調剤を別々におこなえば、人件費などのコストが増えます。差額はそのまま薬の価格に上乗せされるので、患者にしわ寄せがくるわけです。
もちろん経済的負担増に見合うだけのサービス向上を患者が実感できていれば問題はありません。けれども現実はそうではなく、「患者が医業分業のメリットを実感できていない」との指摘がありました。
そこで今回の改正では「患者の立場になった、患者中心の医業分業」つまり患者をどう支えていくかということを、薬剤師・薬局のあり方の見直しというかたちで示しました。

具体的には以下の3点です。
[su_box title=”「Ⅱ薬剤師・薬局のあり方」の概要” box_color=”#005488″]
a薬剤師による継続的な服薬状況の把握および服薬指導の義務の法制化(服薬サポート)
b特定の機能を持つ薬局の認定・表示制度の導入
cテレビ電話等による遠隔服薬指導(オンライン服薬指導)の導入
[/su_box]
参考:中央社会保険医療協議会 総会(第 417 回) 議事次第 令和元年6月26日(水) 9:00~ 於 厚生|厚生労働省
「医業分業の欠点」にかかる政府の今後の展望に関する質問に対する答弁書:答弁本文
a薬剤師による継続的な服薬状況の把握および服薬指導の義務の法制化(服薬サポート)


Ⅱ薬剤師・薬局のあり方の見直し
a薬剤師による継続的な服薬状況の把握および服薬指導の義務の法制化(服薬サポート)
b特定の機能を持つ薬局の認定・表示制度の導入
cテレビ電話等による遠隔服薬指導(オンライン服薬指導)の導入
<背景>
高齢化の進展による多剤投与とその副作用の懸念の高まり
高齢化が進むにつれて、多くの薬を服用しなければならない患者が増えています。
厚生労働省が令和元年6月26日に発表した「医薬品の効率的かつ有効・安全な使用に ついて」によると70代で約6割、80歳以上で約7割の患者が、6種類以上の薬を服用しています。
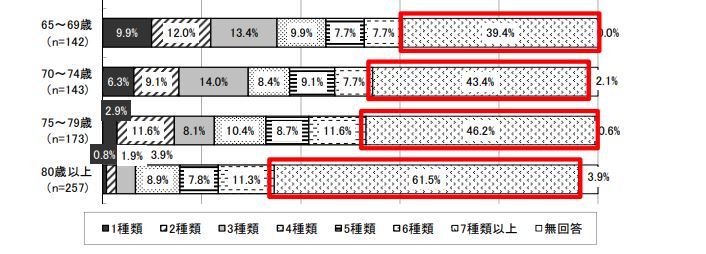

服用する薬が増えると、それだけ飲み合わせの副作用リスクも増大することとなります。飲み忘れ、重複服薬の危険性もあります。
つまり在宅で患者を支える薬剤師・薬局の機能の強化が求められていたのです。
改正内容


💡薬剤師による服薬指導義務などの法制化
改正法試行に伴い、薬剤師による継続的な服薬状況の把握および服薬指導の義務などが法制化されることとなりました。(改正薬機法9条の4第5項、36条の4第5項)
💡薬剤師による服薬指導義務などの法制化の施行期日は令和2年9月1日です。
参考:医薬品の効率的かつ有効・安全な使用に ついて|厚生労働省
[su_box title=”「薬剤師による継続的な服薬状況の把握および服薬指導の義務の法制化(服薬サポート)」により何がどう変わる?” box_color=”#005488″]
✓薬剤師の服薬サポートが法制化される。
✓これにより、患者の飲み忘れや重複服薬、飲み合わせの副作用などを防止し患者が安全・安全に暮らせるようになることが期待される。[/su_box]
b特定の機能を持つ薬局の認定・表示制度の導入


Ⅱ薬剤師・薬局のあり方の見直し
a薬剤師による継続的な服薬状況の把握および服薬指導の義務の法制化(服薬サポート)
b特定の機能を持つ薬局の認定・表示制度の導入
cテレビ電話等による遠隔服薬指導(オンライン服薬指導)の導入
医療機関の周りにはいわゆる門前薬局が数多くあり、処方箋を持っていけばどの薬局でも薬を受け取ることができます。
しかし薬局によって窓口での支払額やサービスに差が出るのが実際です。


健康にかかわる問題ですから、薬を受け取る薬局は費用だけではなく、サービスなども含めて総合的に判断しなければなりません。そのため患者が自分に適した薬局を選ぶための仕組みが必要とされていました。
また、がん等の専門的な治療が求められる病気に対しては特殊な調剤への対応、退院時の支援などの、より丁寧な薬学的管理が求められます。このような状況に適切に対応するためには、以下のような体制が必要です。
- 専門性が高く実践的な経験を持つ医療機関の薬剤師
- 地域の実情に応じて一定の資質を持つ薬局薬剤師が医療機関の薬剤師等と連携しながら対応できる体制
こうした課題をクリアするために、改正法では患者が自身に適した薬局を選択できるような制度設計をしました。
改正内容

💡改正法施行後は、患者が自身に適した薬局を選択できるよう、機能別薬局として、「地域連携薬局」および「専門医療機関連携薬局」に関し、都道府県知事による認定制度(名称独占)が導入されることになります。(改正薬機法6条の2、6条の3)
地域連携薬局…入退院時や在宅医療に他医療提供施設と連携して対応できる薬局
専門医療機関連携薬局…がんなどの専門的な薬学管理に他医療提供施設と連携して対応できる薬局
💡施行期日は令和3年8月1日です
[su_box title=”「特定の機能を持つ薬局の認定・表示制度の導入」により何がどう変わる?” box_color=”#005488″]
✓がんなど専門的な薬を必要とするケースとそうでないケースそれぞれに対応できるよう、「地域連携薬局」および「専門医療機関連携薬局」に都道府県知事による認定制度が令和3年8月1日より導入される。
✓これにより、患者が自身に適した薬局を選択できるようになる。
※認定制度は「名称独占」であり、都道府県知事に認定された薬局のみがその旨を表記できます。
[/su_box]
cテレビ電話等による遠隔服薬指導(オンライン服薬指導)の導入


Ⅱ薬剤師・薬局のあり方の見直し
a薬剤師による継続的な服薬状況の把握および服薬指導の義務の法制化(服薬サポート)
b特定の機能を持つ薬局の認定・表示制度の導入
cテレビ電話等による遠隔服薬指導(オンライン服薬指導)の導入
医師による診療行為については、一定の条件の下で遠隔でも認められてきていました。
けれども薬の処方時におこなわれる薬剤師による服薬指導は、対面によりおこなうことが明記されていて、テレビ電話などを使用して服薬指導をおこなうこと(いわゆるオンライン服薬指導)は認められていませんでした。
改正内容


💡オンライン服薬指導が可能に
対面義務の例外としてテレビ電話などの通信によって服薬指導をおこなうことが可能になりました。
具体的な手段については、厚生労働省令において以下のように定められています。
映像及び音声の送受信により相手の状態を相互に認識しながら通話をすることが可能な方法その他の方法により薬剤の適正な使用を確保することが可能であると認められる方法として厚生労働省令で定めるもの
オンライン服薬指導の実施要領等について(日医発第1326号)
ただし、どんなケースでもオンライン服薬指導が実施できるわけではありません。
改正薬機法9条3第1項を受けて令和2年3月27日付で公布された改正省令により薬機法施行規則15条の13第2項が新設され、以下の条件が付されました。
【オンライン服薬指導を実施する条件(薬機法施行規則15条の13第2項追加分)】
参考:医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律施行令|e-gov
1.「薬局開設者が、その薬局において薬剤の販売又は授与に従事する薬剤師に、同一内容又はこれに準じる内容の処方箋により調剤された薬剤について、あらかじめ、対面により、当該薬剤を使用しようとする者に対して法第九条の三第一項の規定による情報の提供及び指導をおこなわせている場合におこなわれること(薬機法施行規則15条の13第2項1号)」
→「薬を販売・授与をする薬剤師が、患者に対してあらかじめ対面で調剤薬についての情報提供・指導をおこなっている必要がありますよ」ということです。
2.「薬局開設者が、その薬局において薬剤の販売又は授与に従事する薬剤師に、同一内容又はこれに準じる内容の処方箋により調剤された薬剤について、あらかじめ、対面により、薬剤を使用しようとする者に対して服薬指導をおこなわせている場合におこなわれること(薬機法施行規則15条の13第2項2号」
→「薬を販売・授与をする薬剤師が、患者に対してあらかじめ対面で調剤薬についての服薬指導をおこなっている必要がありますよ」ということです。
3.「次に掲げる事項を定めた服薬指導計画に従っておこなわれること(薬機法施行規則15条の13第2項3号 )
(ⅰ) オンライン服薬指導で取り扱う薬剤の種類及びその授受の方法に関する事項
(ⅱ) オンライン服薬指導並びに対面による服薬指導の組合せに関する事項
(ⅲ) オンライン服薬指導をおこなうことができない場合に関する事項
(ⅳ) 緊急時における処方箋を交付した医師又は歯科医師が勤務する病院又は診療所その他の関係医療機関との連絡体制及び対応の手順に関する事項(
ⅴ) その他オンライン服薬指導において必要な事項
このように要件が課されていて、どんなケースでもオンライン服薬指導が可能なわけではない点に留意が必要です。
💡オンライン服薬指導制度の施行期日は令和2年9月1日です。
[su_box title=”「テレビ電話等による遠隔服薬指導(オンライン服薬指導)の導入」により何がどう変わった?” box_color=”#005488″]
✓条件を満たせば、オンライン服薬指導ができるようになった。
✓これにより、患者は薬局や医療施設に通わずに服薬指導を受けられるようになった。[/su_box]
Ⅲ信頼確保のための法令遵守体制などの整備


背景
- 製造販売業者の製造販売や品質保生、安全管理などの法律上の位置づけが不明確で連携がうまくいかず法令遵守のための体制が機能していない
- 薬機法違反事案の多くは製造販売業者等の経営陣が法律上の問題点を把握していない、あるは把握していても適切な対応が取れないことに起因するものである
現行の制度下でも、コンプライアンスの徹底のために研修を開いたり、社内規定をつくるなどの努力をしている企業はあります。しかし多くにおいて製造販売、品質保証、安全管理などにおける責任者の法律上の位置づけが不明確です。
そのため部門間の連携がうまくいかず、法令遵守のための体制が機能していないところが少なくないのが実際です。
そして薬機法違反事案の多くは以下の点に原因があります。
- すべての業務決定を下す経営陣がそもそも法律上の問題点を把握していない
- 法律上の問題点は把握しているが適切な対応が取れない
そこでコンプライアンスのための整備義務や違反を減らすための制度の導入などを「信頼確保のための法令遵守体制などの整備」という形で示しました。具体的には次の3点です。


[su_box title=”「Ⅲ信頼確保のための法令遵守体制などの整備」の概要” box_color=”#005488″]
a薬機法の許可等業者に対する法令遵守体制の整備の義務付け
b国内未承認の医薬品等の輸入に係る確認制度の法制化、麻薬取締官等による捜査対象化
c虚偽・誇大広告による医薬品、医療機器などの販売に係る課徴金制度・措置命令の導入
[/su_box]
a薬機法の許可等業者に対する法令遵守体制の整備の義務付け


Ⅲ信頼確保のための法令遵守体制などの整備
a薬機法の許可等業者に対する法令遵守体制の整備の義務付け
b国内未承認の医薬品等の輸入に係る確認制度の法制化、麻薬取締官等による捜査対象化
c虚偽・誇大広告による医薬品、医療機器などの販売に係る課徴金制度・措置命令の導入
<背景>
- 責任役員の法律上の位置づけがあいまい
- 法令遵体制整備等の責任の所在が不明確
- 製造販売業者等の経営陣が法律を理解していないことによる違反事例の増加
薬機法では、これまでも製造販売業者に対して以下の責任者の設置を義務付けてきました。
- 「総括製造販売責任者」
- 「品質保証責任者」
- 「安全管理責任者」
他方、これらの職務を担う者の組織内での立場や責務、経営陣との関係については、明確に定められていませんでした。くわえて、法令遵守やそのための社内体制整備等の責任の所在が不明確であることもかねてより課題になっていました。
そのため、次のような社内構造上の問題が生じがちだったのです。
責任者の立場や責務の内容、社内での位置づけが明確でなかったため生じがちだった問題
- 技術責任者による意見申述が適切におこなわれない
- 法令遵守のための改善サイクルが機能しない
また近年増加する薬機法違反は、次のような要素に根本的な原因があるケースが少なくありません。
よくある薬機法違反の根本的な原因
- 製造販売業者等の経営陣が法律上の問題点を把握していないこと
- 問題点に対して製造販売業者等が適切な対応をおこなっていないこと
違反を減らすには次のようなことが必要です。
薬機法違反を減らすために必要なこと
- コンプライアンスのための社内規定を整備すること
- 研修などを通じてすべての従業員に社内規定や法令順守の重要性を周知させること


そこで本改正では次の旨の規定が設けられました。
- 「薬事に関する業務に責任を持つ役員」を法律上の位置づけ、それを許可申請書に記載しなければならない(改正薬機法12条2項2号)
- 総括製造販売責任者と製造管理者を設置する(改正薬機法17条3項)
- 「製造販売業者・製造業者にコンプライアンス上の問題点を把握し、解決するための措置(記録体制の整備社内規定の作成・周知など)の実施を求める」(改正薬機法18条の2第1項)
- コンプライアンス体制の整備が不十分な場合に、製造販売業者・製造業者に対して改善を命ずる権限を厚生労働大臣に付与する(改正薬機法72条の2の2)
1「薬事に関する業務に責任を持つ役員」の法律上の位置づけ、許可申請書への記載義務化(改正薬機法12条2項2号)


💡「薬事に関する業務に責任を持つ役員(以下責任役員)」の法律上の位置づけが義務化され、許可申請書にもこの役員名を記載しなければならなくなります。
製造販売業者・製造業者の法令遵守に責任を持つ者を明確にするため、「薬事に関する業務に責任を持つ役員」を法律上位置付けるとともに、許可申請書記載事項とする
改正薬機法12条2項2号
「責任役員」は、取締役であり、執行役員は含まれないとされています。
💡許可等業者における法令遵守体制の整備に関する規定の施行期日は令和3年8月1日です。
2総括製造販売責任者と製造管理者の設置(改正薬機法17条)


総括製造販売責任者と製造管理者を設置し、意見申述をしなければならなくなります。
医薬品、医薬部外品又は化粧品の製造販売業者は、厚生労働省令で定めるところにより、医薬品、医薬部外品又は化粧品の品質管理及び製造販売後安全管理を行わせるために、医薬品の製造販売業者にあつては薬剤師を、医薬部外品又は化粧品の製造販売業者にあつては厚生労働省令で定める基準に該当する者を、それぞれ置かなければならない。
(中略)
医薬品等総括製造販売責任者は、医薬品、医薬部外品又は化粧品の品質管理及び製造販売後安全管理を公正かつ適正に行うために必要があるときは、製造販売業者に対し、意見を書面により述べなければならない。
改正薬機法17条
💡改正法施行後は「総括製造販売責任者」「製造管理者」の設置が義務付けられます。総括製造販売責任者と製造管理者は、法令遵守に必要な能力と経験を持つことが必要とされています。
また💡総括製造販売責任者・製造管理者は品質管理等を適切におこなうため、業者に対して書面で意見申述する法律上の義務が生じます。業者は総括製造販売責任者と製造管理者の意見をが聞き、責任役員はそれ応じた措置をとらなければなりません。
💡「総括製造販売責任者」「製造管理者」の設置が義務付けの施行期日は令和3年8月1日です。
3製造販売業者・製造業者に、コンプライアンス上の問題点を把握し、解決するための措置の実施を求める(改正薬機法18条の2)


医薬品、医薬部外品又は化粧品の製造販売業者は、(中略)薬事に関する法令の規定の遵守を確保するために、厚生労働省令で定めるところにより、次の各号に掲げる措置を講じなければならない。
一 医薬品、医薬部外品又は化粧品の品質管理及び製造販売後安全管理に関する業務について、医薬品等総括製造販売責任者が有する権限を明らかにすること。
二 医薬品、医薬部外品又は化粧品の品質管理及び製造販売後安全管理に関する業務その他の製造販売業者の業務の遂行が法令に適合することを確保するための体制、当該製造販売業者の薬事に関する業務に責任を有する役員及び従業者の業務の監督に係る体制その他の製造販売業者の業務の適正を確保するために必要なものとして厚生労働省令で定める体制を整備すること
改正薬機法18条の2
コンプライアンス上の問題点を把握し、解決するための措置の実施が求められるようになります。例としては、次のような措置が挙げられるでしょう。
社内規程等の整備
たとえば、薬機法遵守のための社内規程等の仕組み作りです。
薬機法順守のための仕組み作りの例
- 薬機法に関する知識共有体制
- 未承認医薬品に該当する製品を作らないための確認体制
- 販売前のチェック体制など
教育訓練等を通じた当該社内規程等の周知・徹底
もちろんルールを作っただけでは意味がありません。作成した社内規定を周知・徹底することも求められます。
作成した社内規定を周知・徹底するための措置の例
- 研修会
- 社内勉強会など
従業者が行った業務の内容が適時かつ正確に記録されるための体制
従業員が「いつどこで、どんな業務をおこなったか」を記録できる体制作りも求められます。
従業者が行った業務の内容が適時かつ正確に記録されるための体制の例
- 作業や出納、通信、出稿記録の電子化
- 電子化したデータの保全など
💡コンプライアンス上の問題点を把握し、解決するための措置の実施が求められるようになります。
💡コンプライアンス遵守の体制の整備に関する規定の施行期日は令和3年8月1日です。
4コンプライアンス体制の整備が不十分な場合に、製造販売業者・製造業者に対して改善措置を命ずる権限を厚生労働大臣に付与する(改正薬機法72条の2の2)


💡整備が不十分な業者に対して、厚生労働大臣や都道府県知事は改善命令をおこなうことができるようになります。
厚生労働大臣は、医薬品、医薬部外品、化粧品、医療機器若しくは再生医療等製品の製造販売業者若しくは製造業者又は医療機器の修理業者に対して、都道府県知事は、薬局開設者、医薬品の販売業者、第三十九条第一項若しくは第三十九条の三第一項の医療機器の販売業者若しくは貸与業者又は再生医療等製品の販売業者に対して、(中略)による措置が不十分であると認める場合においては、その改善に必要な措置を講ずべきことを命ずることができる。
改正薬機法72条の2の2
対象は、医薬品や医薬部外品の製造販売業者や薬局などだけではなく、医療機器の製造販売業者、製造業者、もしくは配置販売業者や卸売業者にも及びます。
💡施行期日は令和3年8月1日です。
[su_box title=”「薬機法の許可等業者に対する法令遵守体制の整備の義務付け」により何がどう変わる?” box_color=”#005488″]
✓「薬事に関する業務に責任を持つ役員」の法律上の位置付けがなされる。
✓それぞれの担う役割や相互関係が明確になるとともに、意見交換が促進され、コンプライアンスに繋がることが期待される。
✓製造業者や製造販売業者には法令遵守ための社内規程等の整備やその周知などコンプライアンスの体制整備を求め、整備が不十分な業者には厚生労働大臣が改善命令を出せる旨を定めた。
✓これによりコンプライアンスの体制が整い法を遵守した企業運営に繋がることが期待される。
[/su_box]
b国内未承認の医薬品等の輸入に係る確認制度の法制化、麻薬取締官等による捜査対象化


Ⅲ信頼確保のための法令遵守体制などの整備
a薬機法の許可等業者に対する法令遵守体制の整備の義務付け
b国内未承認の医薬品等の輸入に係る確認制度の法制化、麻薬取締官等による捜査対象化
c虚偽・誇大広告による医薬品、医療機器などの販売に係る課徴金制度・措置命令の導入
<背景>
- 承認書と異なる製造方法による医薬品の製造販売
- 医療用医薬品の偽造品の流通
- 虚偽の申請により受けた薬監証明※に基づく未承認医療機器の輸入事案
- 同一開設者の開設する薬局間における処方箋の付け替え
日本では承認されていない「日本未承認医薬品」の輸入がかねてより問題視されていました。
もっとも未承認医薬品の輸入にも一定のメリットはあります。
たとえば、国内では承認されていないものの、海外では承認されている治療薬があった場合、輸入し投与することで患者は助かるかもしれません。


ですが実態は転売目的での輸入がほとんどを占め、偽造医薬品の流通も多い※1のが現状です。なかには重篤な副作用をひきおこした事例も存在します。
違法な輸入や偽造医薬品の流通は、これまでも薬監証明制度※2(未承認医薬品・医療機器等の輸入に関する監視の確認制度)によって取り締まられていました。しかし法制化はされていない状態だったため薬機法上の取り締まりが困難でした。
(※1)平成31年3月8日に税務省が発表した(平成 30 年の税関における知的財産侵害物品の差止状況)によれば、税関による医薬品の知的財産侵害物品の輸入差止めは90万点を超え、多くの偽造医薬品が輸入される状態が続いています。
(※2)薬監証明とは、医薬品・医薬部外品・化粧品・医療機器を海外から輸入する際通関で必要となる書類のひとつです。
参考:偽造医薬品への取り組み - 製薬企業の立場から -|厚生労働省
偽造医薬品対策|偽造医薬品対策|グローバルヘルス|日本製薬工業協会
偽造医薬品問題―日本と海外― Counterfeit Medicines―Japan and the World―|J-Stage
💡そこで本改正で薬監証明制度が法制化されました。今後は薬機法に基づく指導・取締りがおこなわれることとなります。
[su_box title=”「国内未承認の医薬品等の輸入に係る確認制度の法制化、麻薬取締官等による捜査対象化」により何がどう変わる?” box_color=”#005488″]
✓薬監証明制度を法制化することで、偽造品など違法な医薬品の輸入や製造販売、流通を薬機法で取り締まりできるようになります。
✓これにより違法な医薬品の輸入や製造販、流通を減ずることが期待されます。
[/su_box]
c虚偽・誇大広告による医薬品、医療機器などの販売に係る課徴金制度・措置命令の導入


Ⅲ信頼確保のための法令遵守体制などの整備
a薬機法の許可等業者に対する法令遵守体制の整備の義務付け
b国内未承認の医薬品等の輸入に係る確認制度の法制化、麻薬取締官等による捜査対象化
c虚偽・誇大広告による医薬品、医療機器などの販売に係る課徴金制度・措置命令の導入
<背景>
- 虚偽・誇大広告違反の罰金が少なく、抑止力にならない
- 薬機法上の業許可を持たない事業者に対しては行政処分ができない
- やり得の甘受
現行の法律でも広告に違法性があった場合には、刑事処分や行政処分で処分がおこなわれます。しかし違法な広告で得た収益は、罰を受けても違反事業者の手元に残ってしまうという問題点があります。
つまり”やり得”を許してしまっている状態です。
また現行の法律では虚偽・誇大広告に違反した場合の罰金は個人・法人ともに200万円以下とされていることから抑止力がいまひとつ利きません。
薬機法上の業許可を持たない事業者によりおこなわれる違反事例に関しては、許可の取消しや業務停止命令といった行政処分を課せられないため抑止効果が働きにくいという問題もあります。
こうした背景から、今回課徴金制度の導入が決定されました。
改正内容


💡売上額の4.5%の課徴金制度が導入される
改正法では医薬品、医療機器などの名称、製造方法、効能、効果または性能に関する虚偽・誇大な広告 (課徴金対象行為)を行った者に対し、違反行為をおこなっていた期間(3年間を上限とする)中における対象商品の売上額の4.5%を課徴金額とし、課徴金納付命令をおこなわなければならない旨の規定が設けられました (改正薬機法66条1項、75条の5の2第1項、第2項)。
💡課徴金制度導入の施行期日は令和3年8月1日です。
ただし例外規定も設けられています。
薬機法の課徴金制度の例外規定の概要
- 消費者への影響が小さい場合は課徴金納付命令が出ないケースもある
- 課徴金が225万円以下の場合は対象外
- 同じ事案で景品表示法でも課徴金納付命令がある場合景品表示法の課徴金額を差し引いた額(4.5%‐3%=1.5%)が薬機法上の課徴金額となる
- 事前に違反を自主申告した場合課徴金額が半分に減額される
条文では次のように規定されています。
厚生労働大臣は、次に掲げる場合には、課徴金対象行為者に対して同項の課徴金を納付することを命じないことができる。
改正薬機法第75条の5の2第3項1号
一 第七十二条の四第一項又は第七十二条の五第一項の命令をする場合(保健衛生上の危害の発生又は拡大に与える影響が軽微であると認められる場合に限る。)
つまり業務改善命令などの処分をする場合で、保健衛生上の危害の発生・拡大への影響が軽微である場合などには課徴金納付命令が発出されないケースもあるということです。
第一項の規定により計算した課徴金の額が二二五万円未満の場合には課徴金納付命令を命ずることができない
改正薬機法第75条の5の2 4
課徴金の額を計算した結果225万円未満(=課徴金対象期間の売上が5000万未満)の場合、課徴金納付命令は発出されないということです。
前条第一項の場合において、厚生労働大臣は、当該課徴金対象行為について、当該課徴金対象行為者に対し、不当景品類及び不当表示防止法(昭和三十七年法律第百三十四号)第八条第一項の規定による命令があるとき、又は同法第十一条の規定により課徴金の納付を命じないものとされるときは、対価合計額に百分の三を乗じて得た額を当該課徴金の額から減額するものとする。
改正薬機法第75条の5の3
同一事案に対する景品表示法の課徴金納付命令がある場合は、薬機法上の課徴金額である売上額の4.5%から景品表示法上の課徴金額である売上額の3%を控除するということです。
厚生労働大臣は、課徴金対象行為者が課徴金対象行為に該当する事実を厚生労働省令で定めるところにより厚生労働大臣に報告したときは、同項又は同条の規定により計算した課徴金の額に百分の五十を乗じて得た額を当該課徴金の額から減額するものとする。
改正薬機法第75条の5の4
課徴金対象行為者が、課徴金対象行為に該当する事実を厚生労働大臣に報告したときは課徴金額の50%が減額されるということです。
ただ、次のように但し書きがあります。
ただし、その報告が、当該課徴金対象行為についての調査があつたことにより当該課徴金対象行為について同項の規定による命令(以下「課徴金納付命令」という。)があるべきことを予知してされたものであるときは、この限りでない。
改正薬機法第75条の5の4
つまり事前に「課徴金納付命令がありそうだ」と知った上で自主申告した場合は課徴金の減額はおこなわれません。
ご覧のように、危害が軽微な場合には課徴金の納付を免れる、課徴金対象行為に該当する事実を厚生労働大臣に報告した場合は減額されるなどの措置が設けられています。
他方、景品表示法に定められているような相当の注意を怠った者でないと認められるときに課徴金の規定の適用を除外する規定などは盛り込まれていません。つまり、これまで以上に細心の注意が必要です。
参考:全国厚生労働関係部局長会議 説 明 資 料
景品表示法の減免規定、認められる誇張の範囲については以下の記事で解説しています。




[su_box title=”「虚偽・誇大広告による医薬品、医療機器などの販売に係る課徴金制度・措置命令の導入」により何がどう変わる?” box_color=”#005488″]
✓令和3年8月1日より、薬機法の虚偽誇大広告規定に課徴金制度が導入される。
✓これにより違反企業は売上額の4.5%もの金額を納める義務が生じ、違反が減ることが見込まれる。
[/su_box]
今回の薬機法改正は企業にとって厳しいものに!しかるべき対応が急務


今回の法改正のメインテーマは「Ⅰ医薬品、医療機器等が安全かつ迅速に提供され」「Ⅱ薬剤師及び薬局が地域の中でその専門性に基づく役割を果たし」「Ⅲ、関係事業者が法令遵守体制の整備をおこなうこと」の3つです。
特にⅢ、関係事業者が法令遵守体制の整備をおこなうことについては実務に直接的な影響を与えます。施行日は公布から1年、2年、3年の3段階となっていて、施行済みのものもあります。しかるべき対策が急務といえるでしょう。
「未承認医薬品製造販売・広告の禁止(第68条)」の条項に変わりはありませんので、広告表現には引き続き気をつける必要があります。
Life-lighterでは好かれて売れる薬機法コンテンツを提供しています。











